|
НОВОСТИ
|
Устойчивость атома водородаПредставление об атомах как неделимых мельчайших частицах вещества возникло в античные времена. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и прочими характеристиками образующих его атомов. Так у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов. Атомы считались неделимыми частицами. В XIX веке изучение атомистического строения вещества существенно продвинулось вперед. В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита это упорядоченное движение заряженных частиц – ионов. Фарадей определил минимальный заряд иона, который был назван элементарным электрическим зарядом. Его приближенное значение оказалось равным e = 1,60·10–19 Кл. На основании исследований Фарадея можно было сделать вывод о существовании внутри атомов электрических зарядов. Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д. И. Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов. Все атомы должны содержать электроны. Но как электроны в них расположены? Физики могли лишь философствовать, исходя из своих познаний в области классической физики... Важным свидетельством сложной структуры атомов явились спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра. Впоследствии, в 1885 г. И. Бальмером были установлены математические закономерности, связывающие длины волн этих линий. В 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью. В 1897 году Дж. Томсон открыл электрон и измерил отношение e/m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов. Таким образом, на основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом. Перед наукой встал вопрос о внутреннем строении атомов. Модели атомовРанняя планетарная модель атома Нагаоки В 1904 году японский физик Хантаро Нагаока предложил модель атома, названную им «сатурнианской моделью». Нагаока представлял себе атом по аналогии с планетой Сатурн в виде тяжелого положительного ядра, окруженного кольцами из большого числа электронов, и применил к этой модели теорию устойчивости колец Сатурна, разработанную в 1856 г. Максвеллом. Следуя этой теории, Нагаока предполагал, что колебания частиц в плоскости колец должны сопровождаться изменением их устойчивых состояний и испусканием атомных спектров. Модель Нагаоки была неверна, но два следствия из нее оказались пророческими:
Кексовая модель атома Модель Хантаро Нагаока и модель Уильяма Томсона были опубликованы в марте 1904 года в одном Философском журнале, но модель Тосмона получила более широкое распространение. В 1902 г. Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны, нейтрализующие положительный заряд. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
Планетарная модель Все упомянутые модели – Томсона – Томсона, Перрена – Нагаоки и Ленарда – являлись сугубо гипотетическими и исключительно качественными. Их можно было подтвердить или опровергнуть только с помощью эксперимента. Экспериментом, который внёс решающий вклад в создание современной теории строения атома, стал опыт, проведённый в 1911 г. Э.Резерфордом совместно со своими ассистентами – Г.Гейгером и Э.Марсденом.
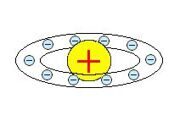
Резерфорд предложил ядерную (планетарную) модель строения атома, в которой атом представлен в виде миниатюрной Солнечной системы. Согласно этой модели, весь положительный заряд и почти вся масса атома (99,4%) сосредоточены в атомном ядре. Размер ядра ничтожно мал по сравнению с размером атома. Вокруг ядра по замкнутым эллиптическим орбитам движутся электроны, образуя электронную оболочку атома. Заряд ядра равен суммарному заряду электронов. Основные положения модели 1.Электроны вращаются вокруг ядра, следовательно, обладают центростремительным ускорением. 2.Энергия атома может иметь произвольное значение, значит, и величина поглощаемой (излучаемой) атомом энергии может быть произвольной. 3. Существует бесконечное множество возможных орбит электронов в атоме. Однако, из классической физики следовало, что
Никакая планетная система, которая подчиняется законам механики Ньютона, никогда после столкновения с другой подобной системой не возвратится в свое исходное состояние. В то время как, например, атом углерода остается атомом углерода и после столкновения с другими атомами или после того, как он, вступив во взаимодействие с другими атомами, образовал химическое соединение. В 1913 году Нильс Бор опубликовал результаты длительных размышлений и расчетов, важнейшие из которых стали с тех пор именоваться постулатами Бора: в атоме всегда существует большое число устойчивых и строго определенных орбит, по которым электрон может мчаться бесконечно долго, ибо все силы, действующие на него, оказываются уравновешенными; электрон может переходить в атоме только с одной устойчивой орбиты на другую, столь же устойчивую. Если при таком переходе электрон удаляется от ядра, то необходимо сообщить ему извне некоторое количество энергии, равное разнице в энергетическом запасе электрона на верхней и нижней орбите. Если электрон приближается к ядру, то лишнюю энергию он «сбрасывает» в виде излучения... 1.Атомная система может находиться только в особых стационарных квантовых состояниях, каждому из которых соответствует определённая энергия Еn. В стационарном состоянии атом не излучает Стационарное состояние наиболее устойчиво – атом может находиться в нём неограниченно долго. Электрон находится на ближайшей к ядру дозволенной орбите. Для каждого атома имеется ряд строго определённых, дискретных, значений энергии, т.е. определённые энергетические уровни. 2. При переходе атома из стационарного состояния с большей энергией Ек в состояние с меньшей энергией Еn излучается квант энергии: Изменение энергии атома может происходить только скачком, дискретно: скачок «вверх» – поглощение кванта энергии, скачок «вниз» – излучение кванта. 3. В атоме допустимы только те орбиты, которые соответствуют одному из энергетических уровней. В стационарном состоянии атома электрон, двигаясь по круговой орбите, имеет дискретное, квантованное значение момента импульса: Мысль о том, что энергия может испускаться и поглощаться лишь дискретными квантами энергии, высказанная Планком, была столь новой, что она выходила за традиционные рамки физики. Попытки Планка примирить новую гипотезу со старыми представлениями об излучении не увенчались успехом. Эта идея, а также объяснение Эйнштейном опытов Ленарда (выбивание из металла электронов под действием света) на основе гипотезы Планка стали первыми шагами в сторону создания квантовой физики. Точная математическая формулировка квантовой теории сложилась в конечном счете в процессе развития двух различных направлений. Одно направление было связано с принципом соответствия Бора. Другое направление исходило из идей де Бройля о волнах материи. Шредингер попытался записать волновое уравнение для стационарных волн де Бройля, окружающих атомное ядро. Таким образом, возник математический формализм, который можно выразить двумя равноправными способами: или с помощью матричных соотношений, или с помощью волновых уравнений. Мы утверждаем, что устойчивость атома водорода может быть объяснена без постулатов и квантовой механики. Более того, устойчивость молекулы водорода доказана нашими классическими расчетами (см. Общая химия ХХI век. Глава 3.). Рассчеты по нашей модели с данными эксперимента совпадают с точностью, равной погрешности эксперимента. Логика наших рассуждений такова. Электрический ток представляет собой упорядоченное движение электрических зарядов, поэтому можно сказать что, то электрон в атоме водорода представляет собой конвекционный ток. Будем рассматривать орбиту электрона как замкнутый контур с током. Каждый проводник с током создает в окружающем пространстве магнитное поле. Движущийся с ускорением заряд, создает переменное магнитное поле. При изменении магнитного потока в контуре возникает индукционный ток, что указывает на наличие в цепи ЭДС индукции, пропорциональной скорости изменения магнитного потока. Индукционный ток, по правилу Ленца, всегда имеет такое направление, что создаваемое им магнитное поле препятствует изменению магнитного потока, вызывающему этот индукционный ток. Т.е. изменение орбиты электрона, будь то уменьшение (увеличение) радиуса или деформация формы орбиты приводит к появлению ЭДС, которая стремится скомпенсировать эти изменения. В своих расчетах модели атома водорода мы показали равенство центробежной и центростремительной сил, действующих на электрон. Центробежная – это ЭДС самоиндукции, а центростремительная – сила Лоренца. Других сил, неэлектрического происхождения в атоме нет. Мы продемонстрировали, что в случае движения заряда с ускорением возникает ЭДС εi электромагнитной индукции. ЭДС действует на заряд силой равной по величине силе, вызвавшей движение заряда с ускорением и противоположной ей по направлению. Величина εi не зависит от способа изменения магнитного потока. Т.е. она не зависит ни от знака ускорения (положительное оно, или отрицательное) ни от типа движения (поступательно-линейное или центростремительно-криволинейное), ни от того, какая именно сила привела к ускоренному движению. Этот закон является общим законом электродинамики. Законы Фарадея представляют собой частный случай этого закона. Проявление действия этого закона вы видите в принципе работы масс-спектрометра и на примере Солнечной системы. Наличие ЭДС и правило Ленца являются необходимыми и достаточным условием для стабильности орбиты в атоме водорода. Более того, подтверждением этого вывода является полная формула для ЭДС самоиндукции, в которой первое слагаемое отвечает за изменение тока в контуре, а второе за деформацию контура. Двигающийся с ускорением элементарный заряд создает ЭДС. ЭДС вызывает силу, воздействующую на заряд. Эта сила равна по величине силе, вызвавшей движение заряда с ускорением, и противоположна ей по направлению. Сила Лоренца описывает движение зарядов в электрических и магнитных полях. В случае атомов и молекул эти поля создаются заряженными частицами (ядрами и электронами), а магнитные движущимися этими же частицами. Равенство по величине центростремительной силы. действующей на заряд. центробежной силе доказывает. что силой. вызвавшей движение заряда с ускорением. является сила Лоренца. Независимым подтверждением этого вывода является устойчивость молекулярных и атомарных орбит электронов в молекулах и атоме водорода. Направление действия силы Лоренца подчиняется правилу Ленца. Согласно этому правилу действие силы на заряд направлено на сохранение величины ускорения, вызвавшего появление ЭДС. Она объясняет также устойчивость атомных и космических орбит. И мы считаем, что она закрывает дискуссию о фиктивности центробежных сил. Сила Лоренца является единственной причиной движения заряда с ускорением. 09.11.2009
|